Nature Communications丨罗敏/卢智刚团队开发快速高效的仿生纳米疫苗
个性化疫苗能够刺激机体产生强烈的肿瘤抗原特异性T细胞反应,一直是癌症免疫治疗领域的研究热点。然而,肿瘤特异性抗原的不确定性,严重限制了个性化疫苗的临床应用。
2025年5月23日,w88优德中文版官网罗敏/卢智刚团队在Nature Communications在线发表一项研究“Neoantigen enriched biomimetic nanovaccine for personalized cancer immunotherapy” [1],开发出基于肿瘤抗原富集性细胞膜(AECM,Antigen-Enriched Cell Membrane)的仿生纳米疫苗AECM@PC7A,为癌症早期介入治疗开拓了一种快速且通用的个性化疫苗新策略。

新抗原是个性化疫苗开发中的一个关键元件,主要通过对患者基因组测序,然后进行抗原序列预测、筛选、及有效性验证,往往需要耗费数月时间,并且预测阳性率低(< 6%)[2,3],导致患者失去早期介入治疗的最佳时机。而利用全肿瘤细胞或者其细胞膜的仿生疫苗,虽能激发多表位T细胞反应,但保护效果弱,难以产生长期有效的生存优势[4]。因此,如何快速获得有效且多样的肿瘤抗原并有效呈递是急需解决的关键问题。
肿瘤能够利用多种机制来压制抗原呈递,从而产生免疫逃逸。因此,研究团队首先通过高通量筛选,确定IFN-γ能够在多种肿瘤中最为显著地刺激MHC-I抗原在细胞表面呈递。继而纯化这些富集了肿瘤抗原的细胞膜(AECM),与纳米佐剂 PC7A混合超声,制备成直径~120 nm的AECM@PC7A纳米疫苗。体外和体内实验显示,AECM@PC7A疫苗能够在低剂量条件下,诱导出强烈的肿瘤特异性CD8+ T细胞反应,且无需提前鉴定具体的肿瘤抗原。
AECM@PC7A疫苗在多种肿瘤模型中展现出广谱抗肿瘤效果。在B16黑色素瘤、MC38结肠癌、CT26结肠癌等多种小鼠模型中,AECM@PC7A疫苗显著抑制肿瘤生长和转移、延长小鼠生存并引起长期免疫记忆保护。团队进一步构建模拟临床术后应用场景的小鼠模型,利用手术切除的肿瘤制备AECM@PC7A疫苗进行免疫,可显著抑制远端转移灶肿瘤生长,提示该策略在术后辅助治疗中的潜力。最后,团队构建免疫系统人源化的CDX移植模型,证明AECM@PC7A疫苗同样能够激活强烈的人CD8+ T细胞反应,在40%的小鼠中MDA-MB-231人乳腺癌肿瘤发生消退。
在机制上,细胞清除实验结果显示,DC和CD8+ T细胞是AECM@PC7A疫苗发挥作用的关键免疫细胞群体。更为独特的是,常规多肽或mRNA疫苗通过cross-presentation来呈递抗原激活T细胞,而AECM疫苗可以将肿瘤细胞膜上整个MHC-I抗原复合物直接 “转移” 到DC表面来激活T细胞;这个过程被称为cross-dressing。和传统cross-presentation途径相比,cross-dressing途径在抗原呈递和T细胞激活上可能更为高效[5]。AECM疫苗可同时通过cross-dressing途径和 cross-presentation传统途径,更高效地呈递抗原,激活 CD8+ T 细胞。
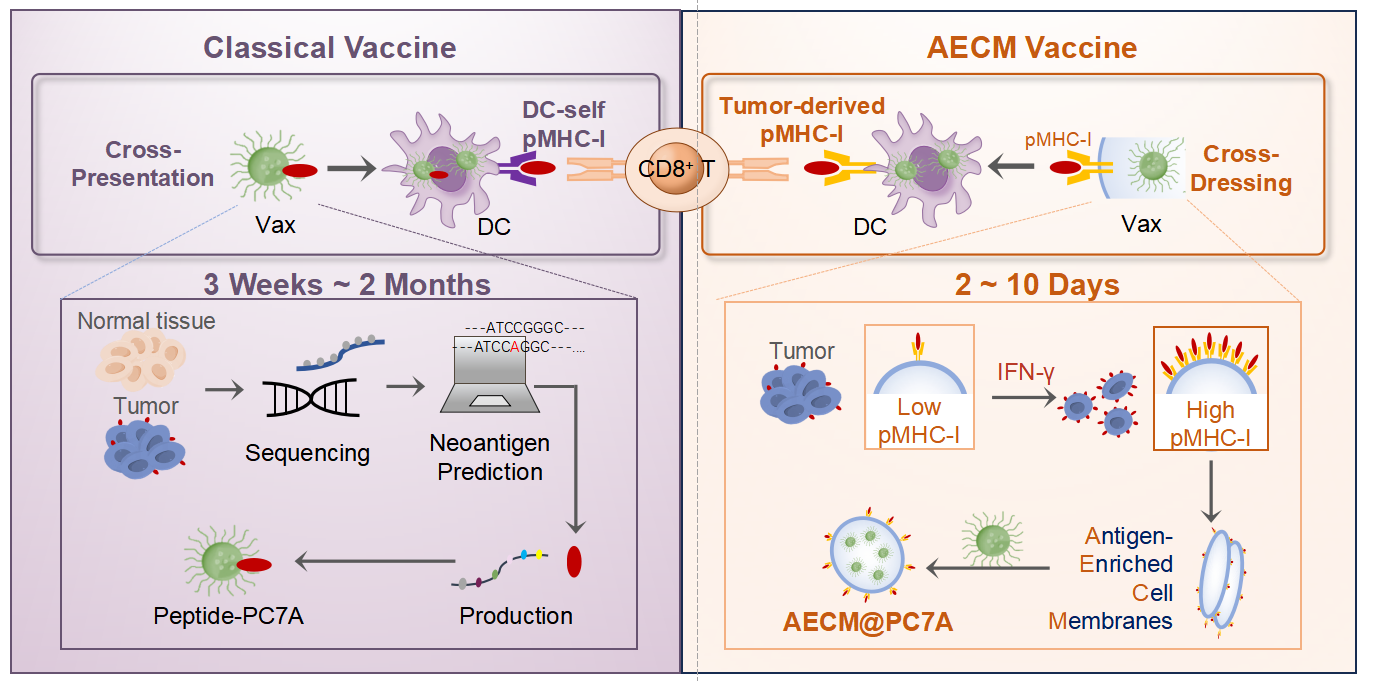
总体而言,相较于传统新抗原疫苗长达~3个月的制备周期,AECM@PC7A疫苗的制备周期短,仅仅需要大约 10天时间,能够实现对患者开展早期干预。同时,该策略无需精准鉴定肿瘤抗原,即可诱导出强烈抗肿瘤效果,适用于多种癌症类型,并且规避了IFN-γ单独使用在肿瘤中的双重复杂效应,以及肿瘤细胞作为抗原的多种反向作用。这项研究成果为个性化癌症疫苗开创了一种快速、通用且高效的全新策略。
w88优德中文版官网博士生李雨薇、方冒馨为文章第一作者,w88优德中文版官网附属儿科医院/w88优德中文版官网罗敏研究员为该论文的通讯作者。
原文链接:https://doi.org/10.1038/s41467-025-59977-8
参考文献:
1: Li, Y., Fang, M., Yu, H. et al. Neoantigen enriched biomimetic nanovaccine for personalized cancer immunotherapy. Nature Communications (2025). DOI: 10.1038/s41467-025-59977-8.
2: Wells, D. K. et al. Key Parameters of Tumor Epitope Immunogenicity Revealed Through a Consortium Approach Improve Neoantigen Prediction. Cell 183, 818-834.e813, doi:10.1016/j.cell.2020.09.015 (2020).
3: Ott, P. A. et al. An immunogenic personal neoantigen vaccine for patients with melanoma. Nature 547, 217-221, doi:10.1038/nature22991 (2017).
4: Ochyl, L. J. et al. PEGylated tumor cell membrane vesicles as a new vaccine platform for cancer immunotherapy. Biomaterials 182, 157-166, doi:10.1016/j.biomaterials.2018.08.016 (2018).
5: MacNabb, B.W., et al. Dendritic cells can prime anti-tumor CD8(+) T cell responses through major histocompatibility complex cross-dressing. Immunity 55, 982-997.e988 (2022).